- Autor Jason Gerald [email protected].
- Public 2024-02-01 14:15.
- Última modificação 2025-01-23 12:43.
Você já deixou uma garrafa de água sob o sol quente por algumas horas e ouviu um leve "assobio" ao abri-la? Isso se deve a um princípio denominado pressão de vapor. Em química, a pressão de vapor é a pressão exercida pelas paredes de um recipiente fechado quando a substância química nele evapora (se transforma em gás). Para encontrar a pressão de vapor em uma determinada temperatura, use a equação de Clausius-Clapeyron: ln (P1 / P2) = (ΔHvapor/ R) ((1 / T2) - (1 / T1)).
Etapa
Método 1 de 3: usando a equação de Clausius-Clapeyron
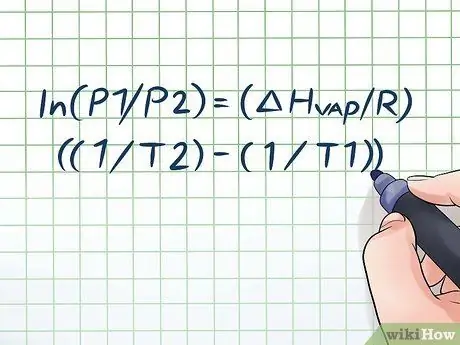
Etapa 1. Escreva a equação de Clausius-Clapeyron
A fórmula usada para calcular a pressão de vapor com a mudança na pressão de vapor ao longo do tempo é chamada de equação de Clausius-Clapeyron (em homenagem aos físicos Rudolf Clausius e Benoît Paul Miles Clapeyron). Esta é basicamente a fórmula de que você precisa para resolver a maioria dos tipos de problemas Perguntas sobre pressão de vapor são freqüentemente encontradas em aulas de física e química. A fórmula é assim: ln (P1 / P2) = (ΔHvapor/ R) ((1 / T2) - (1 / T1)). Nesta fórmula, as variáveis representam:
-
Hvapor:
A entalpia de vaporização de um líquido. Essa entalpia geralmente pode ser encontrada na tabela no final do livro de química.
-
R:
A constante de gás real / universal, ou 8,314 J / (K × Mol).
-
Q1:
A temperatura na qual a pressão de vapor é conhecida (ou temperatura inicial).
-
T2:
A temperatura na qual a pressão de vapor é desconhecida / desejada (ou a temperatura final).
-
P1 e P2:
Pressão de vapor nas temperaturas T1 e T2, respectivamente.

Etapa 2. Insira as variáveis que você conhece
A equação de Clausius-Clapeyron parece complicada porque tem muitas variáveis diferentes, mas na verdade não é tão difícil se você tiver as informações corretas. A maioria dos problemas básicos de pressão de vapor listará dois valores de temperatura e um valor de pressão ou dois valores de pressão e um valor de temperatura - uma vez que você descubra isso, resolver esta equação é muito fácil.
- Por exemplo, digamos que somos informados de que temos um recipiente cheio de líquido a 295 K, cuja pressão de vapor é de 1 atmosfera (atm). Nossa pergunta é: Qual é a pressão de vapor a 393 K? Temos dois valores de temperatura e um valor de pressão, então podemos encontrar os outros valores de pressão usando a equação de Clausius-Clapeyron. Ao conectar nossas variáveis, obtemos ln (1 / P2) = (ΔHvapor/ R) ((1/393) - (1/295)).
- Observe que, para a equação de Clausius-Clapeyron, você deve sempre usar o valor da temperatura Kelvin. Você pode usar qualquer valor de pressão, desde que os valores de P1 e P2 sejam iguais.

Etapa 3. Insira suas constantes
A equação de Clausius-Clapeyron tem duas constantes: R e Hvapor. R sempre é igual a 8,314 J / (K × Mol). No entanto, Hvapor (entalpia de vaporização) depende da substância cuja pressão de vapor você está procurando. Conforme observado acima, você geralmente pode encontrar os valores de Hvapor para várias substâncias no final de um livro de química ou física, ou online (como, por exemplo, aqui).
-
Em nosso exemplo, suponha que nosso líquido seja água pura.
Se olharmos na tabela os valores de Hvapor, descobrimos que Hvapor a água pura é cerca de 40,65 KJ / mol. Como nosso valor de H está em joules, e não em kilojoules, podemos convertê-lo para 40.650 J / mol.
- Conectando nossas constantes, obtemos ln (1 / P2) = (40.650 / 8, 314) ((1/393) - (1/295)).
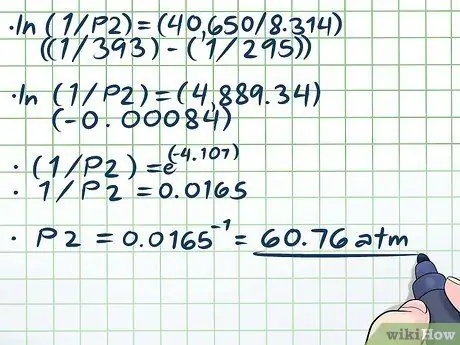
Etapa 4. Resolva a equação
Depois de incluir todas as variáveis na equação, exceto aquela que você está procurando, prossiga para a resolução da equação de acordo com as regras da álgebra comum.
-
A única parte difícil de resolver nossa equação (ln (1 / P2) = (40.650 / 8, 314) ((1/393) - (1/295))) está resolvendo o log natural (ln). Para remover o logaritmo natural, basta usar ambos os lados da equação como expoentes para a constante matemática e. Em outras palavras, ln (x) = 2 → eln (x) = e2 → x = e2.
- Agora, vamos resolver nossa equação:
- ln (1 / P2) = (40.650 / 8, 314) ((1/393) - (1/295))
- ln (1 / P2) = (4889, 34) (- 0, 00084)
- (1 / P2) = e(-4, 107)
- 1 / P2 = 0,0165
-
P2 = 0,0165-1 = 60, 76 atm.
Isso faz sentido - em um recipiente fechado, elevar a temperatura para quase 100 graus (quase 20 graus acima do ponto de ebulição) produzirá muito vapor, aumentando a pressão rapidamente.
Método 2 de 3: Encontrando a pressão de vapor com solução dissolvida
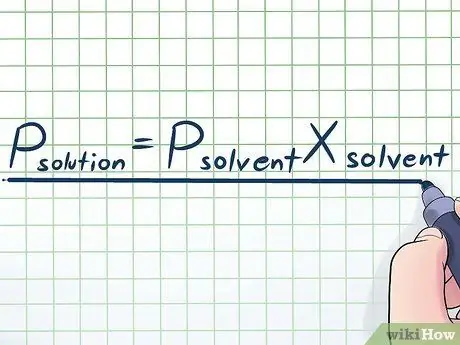
Etapa 1. Escreva a Lei de Raoult
Na vida real, raramente trabalhamos com um líquido puro - normalmente, trabalhamos com um líquido que é uma mistura de várias substâncias diferentes. Algumas das misturas mais comumente usadas são feitas dissolvendo uma pequena quantidade de um determinado produto químico chamado soluto em muitos produtos químicos chamados de solvente para fazer uma solução. Nestes casos, é útil conhecer uma equação chamada Lei de Raoult (em homenagem ao físico François-Marie Raoult), que se escreve assim: Psoluto= PsolventeXsolvente. Nesta fórmula, as variáveis representam;
-
Psoluto:
Pressão de vapor de toda a solução (todos os elementos combinados)
-
Psolvente:
Pressão de vapor de solvente
-
Xsolvente:
Fração molar de solvente
- Não se preocupe se você não conhece termos como fração molar - vamos explicá-los nas próximas etapas.

Etapa 2. Determine o solvente e o soluto em sua solução
Antes de calcular a pressão de vapor de um líquido misturado, você deve identificar as substâncias que está usando. Como um lembrete, uma solução é formada quando um soluto se dissolve em um solvente - o produto químico que se dissolve é sempre chamado de soluto, e o produto químico que o faz se dissolver é sempre chamado de solvente.
- Vamos trabalhar usando os exemplos simples desta seção para ilustrar os conceitos que discutimos. Para nosso exemplo, digamos que queremos encontrar a pressão de vapor do xarope de açúcar. Tradicionalmente, o xarope de açúcar é um açúcar solúvel em água (proporção de 1: 1), então podemos dizer que o açúcar é o nosso soluto e a água é o nosso solvente.
- Observe que a fórmula química da sacarose (açúcar de mesa) é C12H22O11. Essa fórmula química será muito importante.
Etapa 3. Encontre a temperatura da solução
Como vimos na seção Clausius Clapeyron acima, a temperatura de um líquido afetará sua pressão de vapor. Geralmente, quanto mais alta a temperatura, maior a pressão do vapor - conforme a temperatura sobe, mais líquido evapora e forma vapor, aumentando a pressão no recipiente.
Em nosso exemplo, digamos que a temperatura do xarope de açúcar neste ponto é 298 K (cerca de 25 C).
Etapa 4. Encontre a pressão de vapor do solvente
Os materiais de referência química geralmente têm valores de pressão de vapor para muitas substâncias e compostos comumente usados, mas esses valores de pressão geralmente só são válidos se a substância tiver uma temperatura de 25 C / 298 K ou seu ponto de ebulição. Se sua solução tiver uma dessas temperaturas, você pode usar um valor de referência, mas se não tiver, você precisará encontrar a pressão de vapor nessa temperatura.
- O Clausius-Clapeyron pode ajudar - use uma pressão de vapor de referência e 298 K (25 C) para P1 e T1, respectivamente.
- Em nosso exemplo, nossa mistura tem uma temperatura de 25 C, então podemos usar facilmente nossa tabela de referência fácil. Sabemos que a 25 C, a água tem uma pressão de vapor de 23,8 mm HG

Etapa 5. Encontre a fração molar de seu solvente
A última coisa que precisamos fazer antes de resolver isso é encontrar a fração molar de nosso solvente. Encontrar a fração molar é fácil: basta converter seus compostos em moles e, em seguida, encontrar a porcentagem de cada composto no número total de moles na substância. Em outras palavras, a fração molar de cada composto é igual a (moles do composto) / (número total de moles na substância).
-
Suponha que nossa receita para xarope de açúcar use 1 litro (L) de água e 1 litro de sacarose (açúcar).
Nesse caso, devemos encontrar o número de moles de cada composto. Para fazer isso, encontraremos a massa de cada composto e, em seguida, usaremos a massa molar da substância para convertê-la em moles.
- Massa (1 L de água): 1.000 gramas (g)
- Massa (1 L de açúcar bruto): Aprox. 1.056, 8 g
- Moles (água): 1.000 gramas × 1 mol / 18,015 g = 55,51 mol
- Moles (sacarose): 1.056, 7 gramas × 1 mol / 342,2965 g = 3,08 moles (observe que você pode encontrar a massa molar da sacarose em sua fórmula química, C12H22O11.)
- Mols totais: 55,51 + 3,08 = 58,59 mol
- Fração molar de água: 55, 51/58, 59 = 0, 947
Etapa 6. Concluir
Finalmente, temos tudo de que precisamos para resolver nossa equação da Lei de Raoult. Esta parte é muito fácil: basta inserir seus valores para as variáveis na equação simplificada da Lei de Raoult no início desta seção (Psoluto = PsolventeXsolvente).
- Inserindo nossos valores, obtemos:
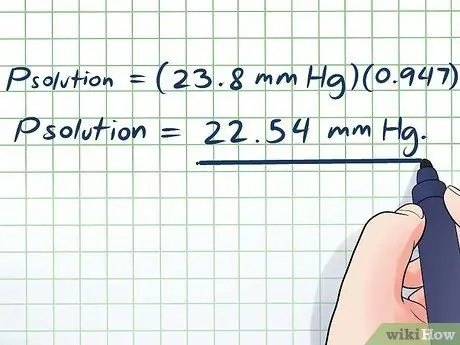
- Psolução = (23,8 mm Hg) (0, 947)
-
Psolução = 22,54 mm Hg.
O resultado faz sentido - em termos de mol, há muito pouco açúcar dissolvido em muita água (embora, em termos do mundo real, os dois ingredientes tenham o mesmo volume), então a pressão de vapor diminuirá apenas ligeiramente.
Método 3 de 3: Encontrando a pressão de vapor em casos especiais

Etapa 1. Cuidado com as condições padrão de temperatura e pressão
Os cientistas costumam usar um conjunto de valores de temperatura e pressão como um "padrão" fácil de usar. Esses valores são chamados de temperatura e pressão padrão (ou STP). Os problemas de pressão de vapor geralmente se referem às condições de STP, portanto, é importante lembrar esses valores. Os valores STP são definidos como:
- Temperatura: 273, 15 K / 0 C / 32 F
- Pressão: 760 mm Hg / 1 atm / 101, 325 quilopascais

Etapa 2. Reorganize a equação de Clausius-Clapeyron para encontrar as outras variáveis
Em nosso exemplo da Parte 1, vimos que a equação de Clausius-Clapeyron é muito útil para encontrar a pressão de vapor de substâncias puras. No entanto, nem todas as perguntas solicitarão que você procure P1 ou P2 - muitas solicitarão que você encontre o valor da temperatura ou às vezes até o valor H.vapor. Felizmente, nesses casos, obter a resposta certa é simplesmente uma questão de reorganizar a equação de modo que as variáveis que você deseja resolver sejam separadas em um lado do sinal de igual.
- Por exemplo, digamos que temos um líquido desconhecido com uma pressão de vapor de 25 torr a 273 K e 150 torr a 325 K, e queremos encontrar a entalpia de vaporização desse líquido (ΔHvapor) Podemos resolver assim:
- ln (P1 / P2) = (ΔHvapor/ R) ((1 / T2) - (1 / T1))
- (ln (P1 / P2)) / ((1 / T2) - (1 / T1)) = (ΔHvapor/ R)
- R × (ln (P1 / P2)) / ((1 / T2) - (1 / T1)) = Hvapor Agora, inserimos nossos valores:
- 8, 314 J / (K × Mol) × (-1, 79) / (- 0, 00059) = Hvapor
- 8, 314 J / (K × Mol) × 3.033, 90 = Hvapor = 25,223, 83 J / mol

Etapa 3. Calcule a pressão de vapor do soluto quando a substância produz vapor
Em nosso exemplo da Lei de Raoult acima, nosso soluto, açúcar, não exerce nenhuma pressão por conta própria em temperaturas normais (pense - quando foi a última vez que você viu uma tigela de açúcar evaporar em seu armário superior?) No entanto, quando seu soluto fez evaporar, isso afetará sua pressão de vapor. Nós explicamos isso usando uma versão modificada da equação da Lei de Raoult: Psolução = (PcompostoXcomposto) O símbolo sigma (Σ) significa que só precisamos somar todas as pressões de vapor dos diferentes compostos para obter nossa resposta.
- Por exemplo, digamos que temos uma solução feita de dois produtos químicos: benzeno e tolueno. O volume total da solução é de 12 mililitros (mL); 60 mL de benzeno e 60 mL de tolueno. A temperatura da solução é de 25 ° C e as pressões de vapor de cada um desses produtos químicos a 25 ° C são 95,1 mm Hg para o benzeno e 28,4 mm Hg para o tolueno. Com esses valores, encontre a pressão de vapor da solução. Podemos fazer isso da seguinte forma, usando valores de densidade padrão, massa molar e pressão de vapor para nossos dois produtos químicos:
- Massa (benzeno): 60 mL = 0,060 L e vezes 876,50 kg / 1.000 L = 0,053 kg = 53 g
- Massa (tolueno): 0,060 L e vezes 866, 90 kg / 1.000 L = 0,052 kg = 52 g
- Mol (benzeno): 53 g × 1 mol / 78, 11 g = 0,679 mol
- Moles (tolueno): 52 g × 1 mol / 92, 14 g = 0,564 mol
- Moles totais: 0,679 + 0,564 = 1,243
- Fração molar (benzeno): 0,679 / 1, 243 = 0,546
- Fração molar (tolueno): 0,564 / 1, 243 = 0,454
- Solução: Psolução = PbenzenoXbenzeno + PtoluenoXtolueno
- Psolução = (95,1 mm Hg) (0, 546) + (28,4 mm Hg) (0, 454)
- Psolução = 51,92 mm Hg + 12,89 mm Hg = 64, 81 mm Hg
Pontas
- Para usar a equação de Clausius Clapeyron acima, a temperatura deve ser medida em Kelvin (escrita como K). Se você tem a temperatura em Celsius, deve convertê-la usando a seguinte fórmula: Tk = 273 + Tc
- Os métodos acima podem ser usados porque a energia é exatamente proporcional à quantidade de calor aplicada. A temperatura do líquido é o único fator ambiental que afeta a pressão do vapor.






