- Autor Jason Gerald [email protected].
- Public 2023-12-16 11:33.
- Última modificação 2025-01-23 12:43.
Diluição é o processo de tornar uma solução concentrada mais diluída. Existem várias razões pelas quais alguém pode querer fazer uma diluição, desde razões sérias a simples. Por exemplo, os bioquímicos diluem soluções de suas formas concentradas para fazer novas soluções para uso em experimentos, enquanto, por outro lado, os bartenders frequentemente diluem o licor com refrigerantes ou sucos para tornar os coquetéis mais saborosos. A fórmula geral para calcular a diluição é C1V1 = C2V2, com C1 e C2 representa as concentrações inicial e final da solução, respectivamente, e V1 e V2 representa o volume.
Etapa
Método 1 de 2: Diluição precisa de concentrados por meio da equação de diluição

Etapa 1. Determine o que você sabe e o que não sabe
Diluição em química geralmente significa tomar uma pequena quantidade de uma solução cuja concentração você conhece e, em seguida, adicionar um líquido neutro (como água) para fazer uma nova solução com um volume maior, mas com menor concentração. Isso é frequentemente feito em laboratórios de química, porque, por uma questão de eficácia, os reagentes são freqüentemente armazenados em concentrações muito altas, que são então diluídas para uso em experimentos. Normalmente, na maioria das situações do mundo real, você saberá a concentração de sua solução inicial e a concentração ou o volume que deseja que seja a concentração final, mas não o volume da solução inicial de que precisa para obter a solução final.
- No entanto, em outras situações (especialmente em problemas escolares), você pode precisar encontrar outras peças do quebra-cabeça - por exemplo, você pode receber um volume e uma concentração iniciais e depois ser solicitado a encontrar a concentração final se diluir uma solução. para o volume desejado. Em qualquer caso de diluição, é útil observar as variáveis conhecidas e desconhecidas antes de começar.
-
Vamos terminar o exemplo de perguntas. Suponha que sejamos solicitados a diluir uma solução 5 M com água para fazer 1 L de uma solução 1. milímetros. Nesse caso, sabemos a concentração de nossa solução inicial e o volume e a concentração final que queremos, mas não a quantidade de solução inicial que precisamos adicionar com água para atingir o resultado desejado.
Lembrete: em química, M é uma medida de concentração chamada Molaridade, que denota os moles de uma substância por litro
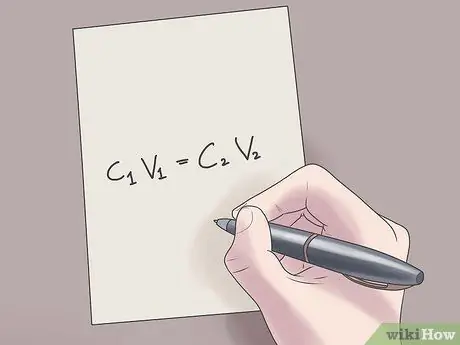
Etapa 2. Insira seus valores na fórmula C1V1 = C2V2.
Nesta fórmula, C1 é a concentração inicial da solução, V1 é o volume da solução inicial, C2 é a concentração final da solução, e V2 é o volume da solução final. Inserir valores conhecidos nesta equação o ajudará a encontrar valores desconhecidos com menos dificuldade.
- Você pode achar útil colocar um ponto de interrogação na frente da unidade que deseja pesquisar para ajudá-lo a resolvê-la.
-
Vamos continuar nosso exemplo. Vamos inserir os valores que conhecemos da seguinte forma:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Nossas duas concentrações têm unidades diferentes. Vamos parar aqui e passar para a próxima etapa.

Etapa 3. Considere todas as diferenças de unidade
Como as soluções envolvem mudanças na concentração (que às vezes pode ser muito grande), não é incomum que as duas variáveis em sua equação tenham unidades diferentes. Embora isso seja fácil de ignorar, unidades desiguais em sua equação podem fazer com que sua resposta esteja incorreta. Antes de terminar, converta todos os valores com diferentes unidades de concentração e / ou volume.
-
Em nosso exemplo, usamos unidades diferentes para concentrações de M (molares) e mM (milimolares). Vamos mudar nossa segunda medição para M:
- 1 mM × 1 M / 1.000 mM
- = 0,001 M

Etapa 4. Concluir
Quando todas as unidades forem iguais, resolva sua equação. Quase sempre isso pode ser feito com álgebra simples.
-
Paramos nosso problema de exemplo aqui: (5 M) V1 = (1 mM) (1 L). Vamos encontrar o valor de V1 com nossa nova unidade.
- (5 M) V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L) / (5 M).
-
V1 = 0,0002 L, ou 0,2 mL.

Etapa 5. Entenda como usar sua resposta corretamente
Digamos que você tenha encontrado o valor ausente, mas não tenha certeza de como usar essa nova informação na diluição real que precisa fazer. Isso é compreensível - a linguagem da matemática e da ciência às vezes não corresponde ao mundo real. Quando você conhece os quatro valores da equação C1V1 = C2V2, faça a diluição da seguinte forma:
- Meça o volume V1 de uma solução com uma concentração de C1. Em seguida, adicione diluente suficiente (água, etc.) para fazer o volume total V2. Esta nova solução terá a concentração que você deseja (C2).
- Em nosso exemplo, por exemplo, primeiro medimos 0,2 mL de uma solução 5 M. Em seguida, adicionaremos água suficiente para aumentar o volume da solução para 1 L: 1 L - 0,0002 L = 0,9998 L, ou 999, 8 mL. Em outras palavras, adicionaremos 999,8 mL de água à nossa solução de amostra pequena. Nossa nova solução diluída tem uma concentração de 1 mM, que é a nossa concentração desejada.
Método 2 de 2: Fazendo uma solução de diluição simples e prática

Etapa 1. Leia qualquer embalagem para obter informações
Existem vários motivos pelos quais você pode querer fazer uma solução de diluição em casa, na cozinha ou em outro laboratório não químico. Por exemplo, fazer suco de laranja a partir de um concentrado simples é uma diluição. Em muitos casos, o produto que precisa ser diluído contém informações sobre a diluição que precisa ser feita, em algum lugar da embalagem. Eles podem ter instruções precisas a seguir. Aqui estão algumas coisas que você deve procurar ao procurar informações:
- Volume de produto usado
- Volume de diluente usado
- Tipo de diluente usado (geralmente água)
- Instruções especiais de mistura
- Você pode não ver informações sobre a concentração exata do líquido usado. Esta informação não é útil para o consumidor médio.

Etapa 2. Adicione a substância que atua como diluente à solução concentrada
Para diluições domésticas simples, como as que você pode fazer na cozinha, você realmente só precisa saber o volume de concentrado que está usando e a concentração final aproximada desejada antes de começar. Diluir o concentrado com uma quantidade adequada de diluente, a qual é determinada em função do volume do concentrado inicial utilizado. Veja abaixo:
- Por exemplo, se quiséssemos diluir 1 xícara de concentrado de suco de laranja em 1/4 de sua concentração inicial, adicionaríamos 3 xícaras água no concentrado. Nossa mistura final terá 1 xícara de concentrado em 4 xícaras de líquido inteiro - 1/4 de sua concentração inicial.
- Aqui está um exemplo mais complicado: se quiséssemos diluir 2/3 xícara de concentrado para 1/4 de sua concentração inicial, adicionaríamos 2 xícaras de água, porque 2/3 xícara é igual a 1/4 vezes 2 e 2/3 xícara de líquido inteiro.
- Certifique-se de adicionar a substância em um recipiente grande o suficiente para conter o volume final desejado - uma tigela grande ou recipiente semelhante.

Etapa 3. Ignore o volume do pó na maioria dos casos
Adicionar um pó (como certas misturas para bebidas) a um líquido geralmente não é considerado uma diluição. A mudança de volume resultante da adição de uma pequena quantidade de pó ao líquido é geralmente pequena o suficiente para ser desprezível. Em outras palavras, ao adicionar uma pequena quantidade de pó a um líquido, basta adicionar o pó ao volume final de líquido desejado e misturar.
Aviso
- Siga todas as orientações de segurança fornecidas pelo fabricante ou exigidas por sua empresa. Isso é especialmente importante se você tiver que diluir a solução ácida.
- Trabalhar com soluções ácidas pode exigir medidas e diretrizes de segurança mais detalhadas do que soluções não ácidas.






