- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:33.
- Última modificação 2025-01-23 12:43.
Se você achar a tabela periódica confusa e difícil de entender, não se preocupe, você não está sozinho! Compreender como a tabela periódica funciona pode ser difícil, mas, ao aprender a lê-la, você terá sucesso na ciência. Comece entendendo a estrutura da tabela periódica e as informações que ela mostra sobre os elementos. Em seguida, você pode estudar cada um dos elementos. Finalmente, use as informações listadas na tabela periódica para descobrir o número de nêutrons em um átomo.
Etapa
Parte 1 de 3: Compreendendo a estrutura da tabela periódica
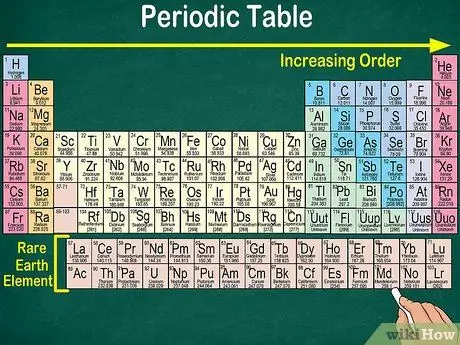
Etapa 1. Leia a tabela periódica do canto superior esquerdo ao canto inferior direito
Os elementos são organizados de acordo com seu número atômico. Quanto mais para a direita e para baixo, maior será o número atômico. O número atômico é o número de prótons que o átomo de um elemento possui. Conforme você avança para a direita, também notará que o número de massa de cada átomo aumenta. Ou seja, você pode entender o peso de um elemento apenas observando sua localização na mesa.
- Quanto mais para a direita ou para baixo, a massa atômica do elemento aumentará porque a massa atômica é calculada somando os prótons e nêutrons em cada átomo do elemento. O número de prótons aumenta com o elemento, o que significa que seu peso também aumenta.
- Os elétrons não são incluídos na massa atômica porque, comparados aos prótons e nêutrons, os elétrons não têm muito efeito no peso atômico.

Etapa 2. Entenda que cada elemento contém 1 próton a mais do que o átomo à sua esquerda
Você pode dizer isso olhando para o número atômico. Os números atômicos são organizados da esquerda para a direita. Os elementos também são separados em 3 grupos, você pode ver o agrupamento na tabela.
Por exemplo, a primeira linha lista o hidrogênio, que tem o número atômico 1, e o hélio, que tem o número atômico 2. No entanto, esses dois elementos estão localizados nas extremidades esquerda e direita da tabela porque estão em grupos diferentes
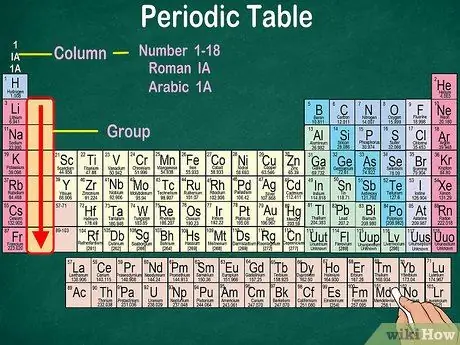
Etapa 3. Identifique grupos de átomos, que possuem as mesmas propriedades físicas e químicas
Os grupos são indicados por colunas verticais. Na maioria dos casos, os grupos são caracterizados pela mesma cor. Isso ajuda a identificar quais elementos têm propriedades físicas e químicas semelhantes. Isso tornará mais fácil para você prever as reações desses elementos. Cada elemento em um determinado grupo tem o mesmo número de elétrons em seu orbital mais externo.
- A maioria dos elementos pertence apenas a um grupo. No entanto, o hidrogênio pode ser classificado como halogênio ou metal alcalino. Em algumas tabelas, o hidrogênio aparece em ambos os grupos.
- Na maioria dos casos, as colunas serão numeradas de 1 a 18, na parte superior ou inferior da tabela. Os números podem ser exibidos em algarismos romanos (IA), algarismos arábicos (1A) ou números (1).
- Leia os grupos atômicos de cima para baixo.
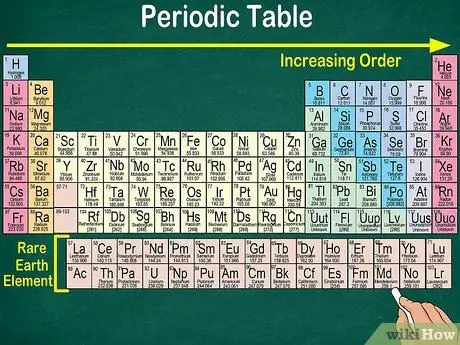
Etapa 4. Observe o espaço em branco na tabela
Além do número atômico, a disposição dos elementos em grupos e grupos também leva em consideração as mesmas propriedades físicas e químicas. Dessa forma, você entenderá melhor como cada elemento reage. A adição de elementos químicos torna sua classificação mais difícil, por isso não é surpreendente que a tabela periódica contenha espaços vazios.
- Por exemplo, as primeiras 3 linhas têm espaços em branco, porque os metais de transição que aparecem na tabela são elementos que têm número atômico 21.
- Da mesma forma, os elementos 57 a 71, que são elementos de terras raras ou elementos de terras raras, são representados separadamente no canto inferior direito da tabela.
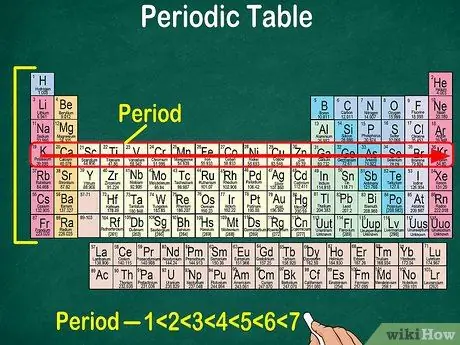
Etapa 5. Observe que cada linha é chamada de período
Todos os elementos em um período têm o mesmo número de orbitais atômicos, pelos quais os elétrons passarão. O número de orbitais corresponderá ao número de períodos. A tabela periódica mostra 7 linhas, o que significa que há 7 períodos.
- Por exemplo, um elemento no período 1 tem 1 orbital, enquanto um elemento no período 7 tem 7 orbitais.
- Na maioria dos casos, os períodos são numerados de 1 a 7 de cima para baixo no lado esquerdo da tabela.
- Leia o período dos elementos seguindo a linha da esquerda para a direita.
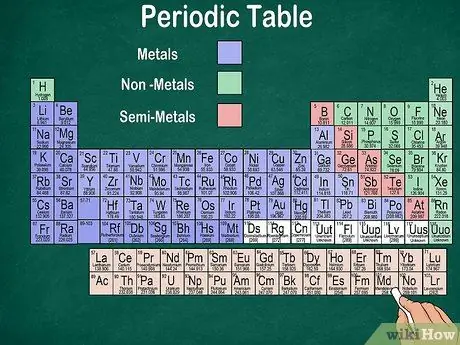
Etapa 6. Distinguir entre metais, semimetais e não metais
Você pode entender melhor as propriedades dos elementos reconhecendo o tipo de elemento. Felizmente, a maior parte da tabela periódica usa cores para indicar se um elemento é um metal, um semimetal ou um não metal. Você encontrará elementos de metal à direita da mesa, enquanto os não-metais à esquerda. O grupo semimetálico está localizado entre metais e não metais.
- Lembre-se de que o hidrogênio pode ser agrupado com os halogênios ou os metais alcalinos por causa de suas propriedades. Portanto, é natural que o hidrogênio apareça em ambos os lados da mesa ou tenha uma cor diferente.
- Um elemento é chamado de metal se for brilhante, sólido à temperatura ambiente, conduzir calor e eletricidade e for macio e elástico.
- Um elemento é considerado não metal se não for brilhante, não conduzir calor ou eletricidade e for duro. Esses elementos são geralmente gasosos em temperatura ambiente, mas também podem ser sólidos ou líquidos em certas temperaturas.
- Um elemento é denominado semimetal se tiver as propriedades combinadas de um metal e de um não-metal.
Parte 2 de 3: estudando os elementos
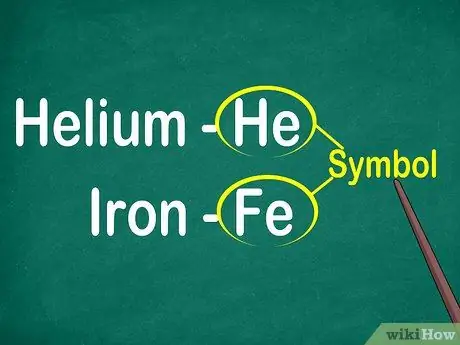
Etapa 1. Identifique os símbolos dos elementos de 1 a 2 letras
O símbolo geralmente está localizado no centro de um quadrado com uma fonte grande. Símbolos são abreviações para nomes de elementos, que foram padronizados em vários idiomas. Ao fazer experimentos ou trabalhar em equações elementares, você provavelmente usará símbolos de elemento. Portanto, goste ou não, você deve se familiarizar com os símbolos elementais.
Os símbolos são geralmente derivados do nome latino do elemento, mas às vezes são derivados de nomes amplamente usados, especialmente novos elementos. Por exemplo, o símbolo para Hélio é He, que representa este nome bem conhecido. No entanto, o símbolo do ferro é o Fe, que é relativamente difícil de detectar à primeira vista

Etapa 2. Encontre o nome completo do elemento, se houver
Este é o nome do elemento que você usará se tiver que escrevê-lo por extenso. Por exemplo, "Hélio" e "Carbono" são nomes de elementos. Na maioria dos casos, o nome do elemento está abaixo do símbolo, mas o posicionamento pode variar.
Algumas tabelas periódicas podem não incluir o nome completo e usar apenas símbolos
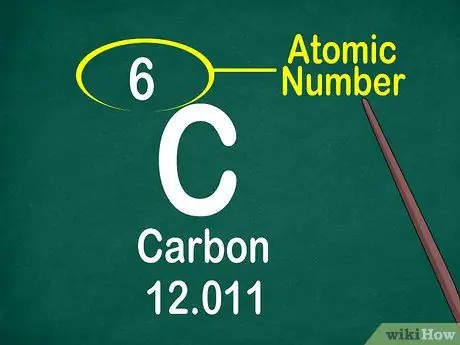
Etapa 3. Observe o número atômico
O número atômico geralmente está localizado na parte superior da caixa, no meio ou no canto da caixa. No entanto, o número atômico também pode ser localizado sob o símbolo do elemento ou nome do elemento. Os números atômicos são ordenados de 1-118.
O número atômico é um número inteiro, não decimal
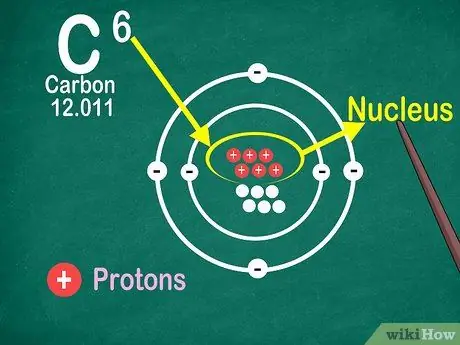
Etapa 4. Saiba que o número atômico é o número de prótons no átomo
Todos os átomos em um elemento têm o mesmo número de prótons. Ao contrário dos elétrons, os prótons não podem ser capturados ou liberados pelos átomos. Os elementos mudarão se os átomos puderem capturar ou perder átomos.
Você também precisa do número atômico para descobrir o número de elétrons e nêutrons
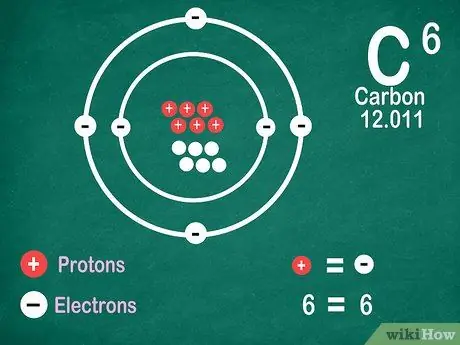
Etapa 5. Saiba que os elementos contêm o mesmo número de elétrons que os prótons, a menos que o elemento seja ionizado
Os prótons têm carga positiva, enquanto os elétrons têm carga negativa. Como um átomo neutro não tem carga elétrica, significa que tem o mesmo número de elétrons e prótons. No entanto, os átomos podem perder e ganhar elétrons, o que os torna ionizados.
- Os íons são cargas elétricas. Se houver mais prótons em um íon, a carga é positiva, que é um sinal positivo (+) próximo ao símbolo do íon. Se o número de elétrons no íon for maior, a carga é negativa, o que é negativo (-).
- Você não verá um sinal positivo ou negativo se um átomo não for um íon.
Parte 3 de 3: Usando o peso atômico para contar nêutrons

Etapa 1. Conheça o peso atômico
O peso atômico geralmente está localizado na parte inferior da caixa, abaixo do símbolo do elemento. O peso atômico é o peso combinado das partículas no núcleo atômico, incluindo prótons e nêutrons. No entanto, os íons podem complicar o processo de contagem. Assim, o peso atômico indica a massa atômica média do elemento e a massa atômica de seus íons.
- Por causa de seu peso médio, a maioria dos átomos tem pesos atômicos na forma decimal.
- Embora o peso de um elemento pareça aumentar da esquerda para a direita, nem sempre é esse o caso.
Etapa 2. Determine o número de massa do elemento que você está estudando
Você pode encontrar o número de massa arredondando a massa atômica. Esse fato prova que o peso atômico é a média de todas as massas atômicas, incluindo os íons.
Por exemplo, o peso atômico do carbono é 12.011, portanto, é arredondado para 12. Da mesma forma, o peso atômico do ferro é de 55,847, portanto, é arredondado para 56
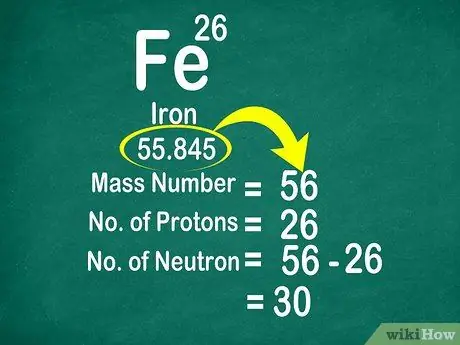
Etapa 3. Subtraia o número de massa do número atômico para contar os nêutrons
O número de massa pode ser calculado somando o número de prótons ao número de nêutrons. Isso tornará mais fácil para você calcular o número de nêutrons em um átomo, subtraindo o número de massa do número de prótons
- Use esta fórmula: Nêutron = Número de Massa - Próton
- Por exemplo, o número de massa do carbono é 12 e tem 6 prótons. Assim, podemos saber que o carbono tem 6 nêutrons porque 12 - 6 = 6.
- Outro exemplo, o número de massa do ferro é 56 e tem 26 prótons. Assim, sabemos que o ferro tem 30 nêutrons porque 56 - 26 = 30.
- Isótopos de átomos contêm diferentes números de nêutrons, então seus pesos atômicos mudam.
Pontas
- Ler a tabela periódica é difícil para algumas pessoas. Não desanime se achar difícil estudar a tabela periódica!
- As cores da tabela podem variar, mas o conteúdo permanece o mesmo.
- Algumas tabelas periódicas podem fornecer informações incompletas. Por exemplo, algumas tabelas fornecem apenas o símbolo e o número atômico. Para isso, procure uma mesa que se adapte às suas necessidades!






